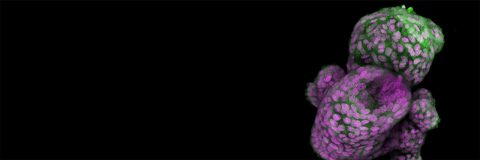
"스페로이드"와 "오가노이드"라는 용어는 잼과 젤리와 비슷합니다.
물론 이 두 용어는 비슷한 의미를 갖고 있으며, 종종 서로 혼용되어 사용됩니다. 대부분의 경우, 어느 것을 사용하든 큰 문제가 없습니다. 하지만 이 둘은 만들어지는 방식과 기능에서 뚜렷한 차이가 있습니다.
단순히 샌드위치를 만들고자 한다면 잼이나 젤리 중 어느 것을 사용해도 괜찮습니다. 하지만 복잡한 3D 세포 배양을 시작하려면, 이 둘의 차이를 알고 적절한 것을 선택하는 것이 중요합니다.