Cell cryopreservation suspends cell line animation, effectively stopping biological time. This may seem like science fiction, but cell cryopreservation is fundamental to cell culturing. It's a meticulous process that requires exquisite precision and care.
冷冻保存细胞会使其处于休眠状态,生物学时间停滞。这听起来像是科幻小说里的情节,但冻存的确是细胞培养过程中的重要一环,操作需要极其精确且谨慎。
那么我们应当如何冻存细胞?下面将分步进行说明。
第1步:选择细胞
当细胞处于最佳状态且接近对数生长末期时,就是冻存细胞的最佳时机。仔细检查培养物是否出现微生物污染。在检测前,使用不含抗生素的培养基培养细胞数代,可使本来可能无法检出的污染物更容易检测出来。
在显微镜下观察样本,然后通过直接培养检测是否存在细菌、酵母、真菌和支原体。支原体污染较为特殊,使用上述方法难以检测出来;需要在冻存后再次对冻存培养物进行检测。
第2步:收集细胞
应根据细胞类型采用适当的方法收集细胞——操作要尽量温和。收集细胞后,洗去或灭活会损伤细胞的解离试剂。仅在必要时使用离心机且操作要温和——尽可能减小离心力,能够形成柔软的沉淀物即可。
将待收集的培养容器中的所有内容物混合,以确保最终冻存细胞的均一性。根据需要稀释或浓缩细胞悬液,使其密度为目标浓度的两倍。
冷却细胞,减缓细胞代谢,防止聚集。必要时,可通入二氧化碳气体以调整pH值,防止偏碱性。

Step 2: Harvest the Cells
Be gentle when harvesting and vary your procedures by cell type. Strive for the optimal freezing concentrations. Low concentrations decrease viability; high concentrations can lead to cell clumping.
Wash off or inactivate any dissociating agents after harvesting because they can damage cells. If you use a centrifuge, only use force hard enough to yield a soft pellet.
Pool the contents of the harvested culture vessels to ensure the uniformity of the final frozen stock. Dilute the concentration of the cell suspension as needed to achieve twice the desired concentration.
Keep cells chilled to slow cell metabolism and prevent clumping. Gas cells with carbon dioxide as necessary to prevent alkaline pH shifts.
Step 3: Store the Cells
Select the right cryoprotective agents, like dimethyl sulfoxide or glycerol, to minimize cell damage. Your storage vessel choice is also critical because improper containers present risks, including injury, vessel damage, contamination, or loss of frozen stock.
The most used cryogenic storage vessels are single-use storage containers, like Corning® cryopreservation bags, and polypropylene screw-capped vials, like Corning internal or external thread cryogenic vials.

Step 4: Cool the Cells for Cryopreservation
Keep your cooling rate steady to ensure cell viability and integrity. It should be slow enough to allow for dehydration but fast enough to prevent dehydration-related damage. For most animal cell cultures, the ideal cooling rate is a steady drop between 1°C and 3°C per minute until they reach -80°C. Larger or less permeable cells might need to cool slower because they dehydrate slower.
Some labs use programmable electronic cooling units to precisely control the freezing process and yield uniform, reproducible results. Other labs use mechanical units that offer sufficient, more affordable process control. Consider using Corning Cool Cell® alcohol-free cell-freezing containers to ensure cells freeze at the ideal cooling rate.
Step 5: Store the Cells
Once cells freeze, it's important to move quickly. Use an insulated container like Corning® CoolCell® for cryopreservation of cells filled with dry ice or liquid nitrogen to transfer the frozen stock to permanent storage. Speed is critical to avoid cell warming or damage.
Most cell culture labs use liquid nitrogen freezers to maintain a consistent temperature below -140°C. Even a brief, temporary temperature rise can damage cells.
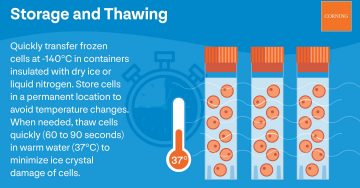
Step 6: Thaw the Cells
While you cool cells gradually, you thaw them rapidly. Quick thawing reduces the formation of damage-causing ice crystals inside cells during rehydration.
Put your container in warm water and stir gently until small ice pellets remain. Cells will continue to thaw as you spray them with ethanol and place them in the hood. You will get the best results by thawing cell cultures for 60 to 90 seconds at 37°C.
Step 7: Let the Cells Recover
To avoid damage from prolonged exposure, remove cells from cryoprotective agents quickly and gently. Remove them based on the type of agent and cells. For example, gentle centrifugation can remove agents from cells sensitive to cryoprotective agents.
Be careful when glycerol is used as a cryoprotectant. Do not suddenly add a large volume of fresh medium to thawed cells — this can damage or destroy them. Instead, take the cells through several stepwise dilutions with an equal volume of warm medium every 10 minutes and let them adjust before further processing.
Most cells recover normally if you remove cryoprotective agents through a medium change within 6 to 24 hours of thawing.
Successfully preserved frozen cells need little maintenance. They can be a lifeline if you lose cell cultures to contamination or accidents. Frozen cell cultures can be useful for long-term experiments because their suspended animation ensures limited biological variants.

Cryopreservation Applications
Cryopreservation Applications
Cryopreservation is valuable and beneficial outside of laboratory experiments. It is widely used in:
- Agricultural biotechnology: Cryopreservation is an affordable long-term conservation approach for fruits and vegetables, reducing genetic modification risk.
- Biobanking: Cryopreservation can support the long-term storage of biological samples and cell lines used in biotechnological research and drug development.
- Regenerative medicine: Cryopreservation of stem cells preserves the cells' potential to regenerate damaged tissue and develop new medical treatments.
- Reproductive medicine: Cryopreservation of sperm, egg, ovarian tissue, and ovary cells promotes artificial insemination and in vitro fertilization efforts.
- Tissue engineering: Cryopreservation safeguards engineered tissues and scaffolds used in tissue engineering. The process supports future implantation and potential therapeutic applications.
Cryopreservation Challenges and Troubleshooting
With all its benefits, cryopreservation can still present challenges:
- Ice crystals: Ice crystal formation during freezing is common; however, crystals damage cell structures and membranes, compromising cell viability. Use precise cooling techniques to reduce ice crystal formation.
- Intracellular ice formation: Some cells are vulnerable to intracellular ice formations that reduce cell viability. Excessive intracellular ice formation can lead to dehydration and cell membrane damage. Specialized cryopreservation protocols and methods can protect cells.
- Cryoprotective agents: High concentrations of cryoprotective agents can be toxic, limiting cell functionality and viability. Carefully balance cryoprotective agents to maintain low toxicity for successful cryopreservation.
- Thawing: Improper thawing reduces cell functionality and viability. Use controlled thawing methods to protect cells.
Cryopreservation is integral to a variety of scientific investigations. As its application opportunities expand, understanding the process's intricacies — and challenges — will become even more important.
第3步:保存细胞
第4步:冷却细胞
冷却速率必须保持不变,且冷却不宜过快,以便细胞有足够的时间脱水,也不宜过慢,防止细胞因脱水而受到损伤。对于大多数的动物细胞,理想的冷却速率是保持在每分钟降温1°C至3°C。对于体积较大或渗透性较低的细胞,因其脱水时间更长,可能需要进一步降低冷却速率。
有些实验室使用可精确控制细胞冷冻过程的程序降温装置,以获得一致且可重复的结果。还有些实验室采用机械装置,以较低的成本实现上述过程的控制。最经济且最常用的细胞冻存方法是使用带聚苯乙烯泡沫盒的超低温冰箱。
第5步:保存细胞
细胞冷冻后,需要尽快转移。使用装有干冰或液氮的隔热容器进行转移,以便永久保存。要避免冻存管升温从而损伤细胞,速度至关重要。
大部分细胞培养实验室使用液氮冷冻装置,但无论选用哪种永久性冷冻保存场所,最重要的是将温度可靠地维持在-130°C以下。
第6步:解冻细胞
冷却细胞时必须逐步降温,而解冻细胞正好相反。快速解冻细胞有助于再水化时减少细胞内冰晶的形成,否则会造成细胞损伤。将容器置于温水中,轻轻搅拌,直至完全解冻。对于大部分细胞而言,在37°C下解冻60至90秒即可获得最佳结果。
第7步:复苏细胞
尽快去除细胞中的冷冻保护剂且操作要尽量温和,以免长时间暴露于冷冻保护剂而造成损伤。去除冷冻保护剂的方法取决于保护剂类型和细胞类型——例如,对冷冻保护剂敏感的细胞需要通过温和的离心来去除。当使用甘油作为冷冻保护剂时,在解冻的细胞悬液中突然加入大量新鲜培养基会损伤细胞或导致细胞死亡。为避免上述情况,应当每10分钟使用等量的预热培养基对细胞进行稀释,分几次逐步完成,让细胞有时间调整,然后再进行后续操作。
一般而言,如果能在解冻后6至8小时内更换培养基,去除冷冻保护剂,大部分细胞均可正常复苏。
细胞成功冻存后,几乎无需维持,当细胞出现污染或意外时,可以随时取用。冻存细胞对于长期实验尤为有用,其休眠状态有助于确保生物学变异处于最低水平。

联系我们

